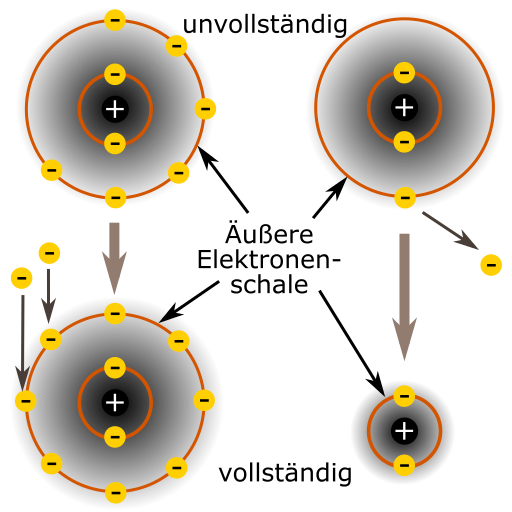
Atome können sich zu Molekülen verbinden. Warum tun Atome dies?
Der Grund ist die Neigung eines Atoms eine VOLLSTÄNDIGE äußere Elektronenschale zu besitzen. Dies kann auf unterschiedliche Art und Weise stattfinden und wird als eine chemische Bindung bezeichnet.
Atome können unter einander Elektronen austauschen, um ihre äußere Elektronenschale (Valenzorbital) vollständig mit Elektronen zu befüllen, oder diese Schale komplett zu vernichten, damit die darunterliegende vollständige Schale als äußere Schale agiert. Dies kann auf unterschiedliche Art und Weise stattfinden und wird als eine chemische Bindung bezeichnet.
Atome können sich auf folgende unterschiedliche Art und Weisen miteinander verbinden.
Ionenbindung
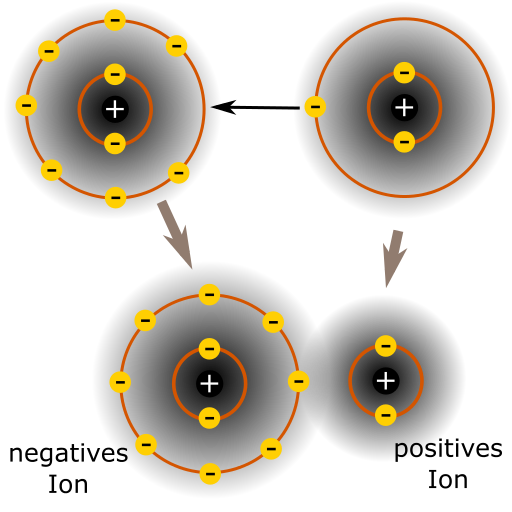
Bei der Ionenbindung gibt ein Atom Elektronen ab. Dabei wird es positiv ionisiert, da es weniger Elektronen als Protonen hat. Gleichzeitig nimmt ein anderes Atom diese Elektronen auf und wird somit negativ ionisiert. Was passiert nun zwischen einem positiv und einem negativ geladenem Atom (auch Ion genannt)?
Positive und negative Ladungen ziehen sich an. Genau das passiert z.B. zwischen Natrium- (Na) und Chlor-Atomen (Cl). Während Na-Atome ein Elektron abgeben und zu Na(+) Ionen werden, nehmen Cl-Atome das Elektron auf und werden zu Cl(-) Ionen. Dadurch ziehen sie sich so stark an, dass das Ergebnis als NaCl bezeichnet wird. NaCl oder (Koch-)Salz ist in jeder Küche vorhanden und trägt, dazu bei, dass das Essen besser schmeckt. Diese chemische Verbindung wird Ionenbindung genannt.
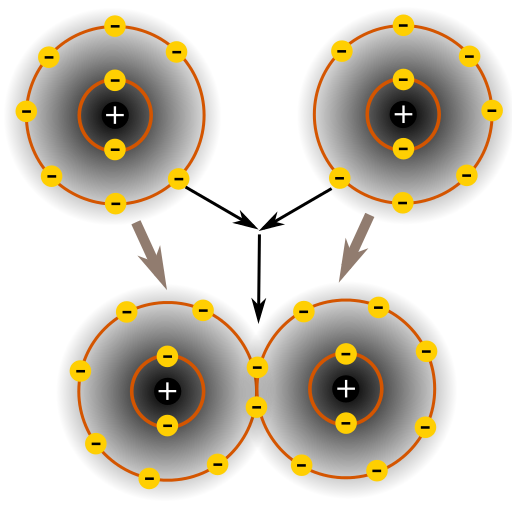
Kovalente Bindung
Wenn zwei Atome beide zusätzliche Elektronen benötigen, um ihre äußere Schale (Valenzorbital) zu vervollständigen, würden sie ein Elektronen-Sharing betreiben. Das Heißt einige Elektronen der äußeren Schale (Valenzelektronen) stehen zeitweise beiden Atomen zur Verfügung. Da sich die Elektronen sehr schnell bewegen, sieht es dann so aus, als ob zu jeder Zeit beide Atome einen vollständigen äußeren Schale (Valenzorbital) hätten. Weißt du wie die Elektronen der äußeren Schale genannt werden?
Die Elektronen der äußeren Schale werden Valenzelektronen genannt. Aus diesem Grund wird diese chemische Verbindung, bei der Elektronen-Sharing betrieben wird als Kovalente Bindung bezeichnet.
Die Kovalente Bindung kann u. U. sehr stark werden. Beispiele für Kovalente Verbindungen sind z. B. Moleküle, die zwei gleiche Atome haben, wie Sauerstoff- (O2) oder Wasserstoff-Moleküle (H2).
Metallische Bindung
Wenn Atome zu wenige Elektronen in der äußeren Schale haben, geben sie diese ab, um ihre äußeren Schalen zu vervollständigen. Dabei bilden sie eine große Gemeinschaft, indem sie alle, die Elektronen ihrer äußeren Schale (Valenzelektronen) in einen negativ geladenen Elektronen-See abgeben, und selbst zu positiven Ionen werden.
Wie soll das aber helfen?
Die Elektronen bewegen sich dann frei umher und bilden somit einen negativ geladenen See aus Elektronen um die positiven Atom-Rümpfe (Ionen). Bildlich gesprochen könnte man sich einen negativ geladenen Kuchenteig mit positiv geladenen Rosinen darin vorstellen. Der Teig würde die Rosinen trotz der Abstoßung festhalten.
Und was ist mit vollständigen äußeren Schalen?
Die Elektronen können in diesem Zustand keinem Atom mehr zugeordnet werden. In diesem negativ geladenen See aus (negativen) Elektronen befinden sich die positiven Ionen mit einer vollständigen äußeren Elektronenschale. Diese Verbindung ist zwar nicht so stark, wie die kovalente oder die ionische Bindung, aber sehr häufig. Könntest du dir vorstellen, welche Elemente diese Verbindung eingehen?
Der Großteil der Elemente im Periodensystem sind Metalle und sie bilden diese Bindung. Deshalb wird sie die metallische Bindung genannt. Reine Metalle, wie z. B. Gold oder Silber kann man sehr leicht biegen, da die Verbindung nicht so stark ist. Durch Hinzufügen von geringen Mengen anderer Elemente wie z. B. Kohlenstoff (C) zu Eisen (Fe) kann die Festigkeit aber stark erhöht werden. Durch diese Legierung entsteht z. B. Stahl.
Funktionelle Gruppen
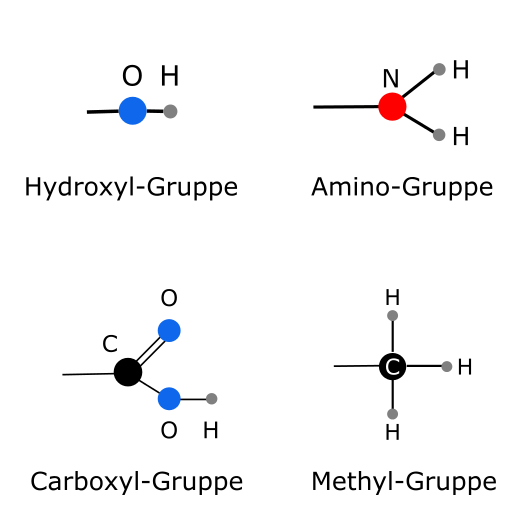
Kohlenstoff (C) ist als ein besonderes Element in der Lage bis zur vier Verbindungen mit anderen Kohlenstoffatomen einzugehen. Dadurch können sehr lange und vielfältige Moleküle (z. B. Makromoleküle und Polymere) mit unterschiedlichen Strukturen und Eigenschaften entstehen. Diese Moleküle werden ORGANISCHE Moleküle genannt.
Und was hat das mit funktionellen Gruppen zu tun?
Funktionelle Gruppen sind bestimmte Atomgruppen in organischen Verbindungen, die die chemischen Eigenschaften des gesamten Moleküls maßgeblich bestimmen bzw. beeinflussen. Ein Beispiel hierfür ist die Amino-Gruppe. Die besteht aus einem Stickstoffatom (N) und zwei Wasserstoffatomen (H). Ein organisches Molekül, das eine Amino-Gruppe besitzt, besitzt bestimmte Eigenschaften. Aminosäuren z. B. (Bausteine von Proteinen) enthalten eine Aminogruppe (-NH2) und eine Carboxylgruppe (-COOH)